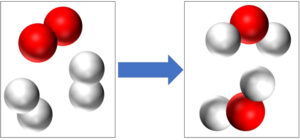
قانون پایستگی جرم یکی از بنیادیترین اصول علم شیمی است که نخستین بار توسط لاوازیه (شیمیدان فرانسوی) در قرن هجدهم مطرح شد. این قانون میگوید: در یک واکنش شیمیایی، مقدار جرم مواد اولیه برابر با مقدار جرم مواد نهایی است. به بیان سادهتر، هیچ جرمی در طی واکنش شیمیایی از بین نمیرود و هیچ جرمی از هیچ به وجود نمیآید؛ بلکه تنها شکل و ترکیب ماده تغییر میکند.
قانون پایستگی جرم میگوید:
“در هر واکنش شیمیایی یا یک تغییر فیزیکی، جرم کل مواد شرکتکننده در واکنش، ثابت میماند.”
مواد اولیه (واکنشدهندهها) ⟷ مواد نهایی (فرآوردهها)
جرم کل واکنشدهندهها برابر است با جرم کل فرآوردهها
این اصل در همهی واکنشهای شیمیایی، از سادهترین واکنشهای آزمایشگاهی تا پیچیدهترین فرایندهای صنعتی و حتی در بدن موجودات زنده، برقرار است. به همین دلیل، قانون پایستگی جرم پایهای برای نوشتن معادلات شیمیایی و موازنهی آنها به شمار میرود.
مثال ساده برای درک بهتر
فرض کنید آهن را در حضور اکسیژن بسوزانیم و زنگ آهن (اکسید آهن) تشکیل شود. اگر جرم آهن و اکسیژن شرکتکننده در واکنش را اندازهگیری کنیم و سپس جرم اکسید آهن تولیدشده را نیز بسنجیم، میبینیم که این دو مقدار دقیقاً با هم برابرند.
به طور مثال، اگر ۵ گرم آهن با ۳ گرم اکسیژن واکنش دهد، محصول نهایی یعنی اکسید آهن نیز دقیقاً ۸ گرم خواهد بود.
این نشان میدهد که جرم مواد فقط از حالتی به حالت دیگر تغییر پیدا کرده است، نه اینکه چیزی از بین برود یا اضافه شود.
دانشآموزان پایه دهم هنگام یادگیری مبحث استوکیومتری به طور مستقیم با این قانون سروکار دارند. برای موازنهی معادلات شیمیایی، همیشه باید مطمئن شویم تعداد اتمهای هر عنصر در سمت واکنشدهندهها و سمت فرآوردهها یکسان است. این کار دقیقاً بر اساس قانون پایستگی جرم انجام میشود.
به همین دلیل، در کلاسهای تدریس خصوصی شیمی دهم یکی از اولین اصولی که آموزش داده میشود همین قانون است. بدون درک درست این قانون، حل مسائل شیمی بهویژه در بخش محاسباتی بسیار دشوار خواهد بود.
ریشه قانون: ثابت بودن تعداد اتمها
دلیل علمی این قانون در سطح اتمی نهفته است. در واقع، یک واکنش شیمیایی صرفاً فرآیندی است که در آن اتمها بازآرایی میشوند.
- ثابت ماندن اتمها: اتمها (اجزای سازنده مواد) در یک واکنش، تولید یا نابود نمیشوند.
- تشکیل ترکیب جدید: آنها فقط پیوندهای قبلی خود را شکسته و پیوندهای جدیدی تشکیل میدهند تا مولکولها و ترکیبات کاملاً جدیدی بسازند.
- چون تعداد و نوع اتمهای هر عنصر در ابتدا و انتهای واکنش برابر است، و جرم هر اتم ثابت است، بنابراین جرم کلی مجموعه هم ثابت میماند.
کاربرد کلیدی در شیمی دهم (موازنه)
مهمترین کاربرد عملی قانون پایستگی جرم در شیمی دهم، در مبحث موازنه کردن معادلات شیمیایی است.
- معادله شیمیایی: یک معادله نمادی، در واقع نقش یک ترازو را دارد. باید در آن توازن برقرار باشد.
- موازنه: ما با قرار دادن ضرایب (اعداد بزرگ) جلوی فرمولهای شیمیایی، اطمینان حاصل میکنیم که تعداد اتمهای هر عنصر در سمت واکنشدهندهها و سمت فرآوردهها دقیقاً برابر باشد.
- این عملِ موازنه، تضمین میکند که معادله نوشته شده، از قانون پایستگی جرم تبعیت میکند.
اهمیت: درک درست این قانون، پایه و اساس یادگیری مباحث محاسباتی شیمی دهم و بهویژه استوکیومتری (محاسبات کمی واکنشها) است و بدون آن، حل مسائل شیمی در مقاطع بالاتر (یازدهم و کنکور) دشوار خواهد بود.
در پایه یازدهم و دوازدهم نیز این قانون اهمیت زیادی دارد. به عنوان نمونه، در مبحث آنتالپی پیوند یا قانون هس، دانشآموز باید بتواند بر اساس پایستگی جرم و انرژی، تغییرات واکنشها را تحلیل کند. همچنین در حل تستهای شیمی کنکور نیز تقریباً همیشه به این اصل نیاز است.
دلیل بنیادین قانون: بقای اتمها و پیوند آن با موازنه شیمیایی
دلیل اصلی که قانون پایستگی جرم برقرار است، در ساختار بنیادین مواد یعنی اتمها نهفته است. بر اساس نظریه اتمی دالتون (که با کشف قانون پایستگی جرم تقویت شد):
- اتمها از بین نمیروند و خلق نمیشوند.
- اتمها در جریان واکنشهای شیمیایی فقط بازآرایی میشوند.
به عبارت دیگر، در یک واکنش شیمیایی، اتمهای مواد اولیه فقط پیوندهای بین خود را میشکنند و آرایش جدیدی برای تشکیل فرآوردهها پیدا میکنند. این درست مانند بازی لگو است؛ شما با همان آجرهای اولیه میتوانید شکلهای کاملاً جدیدی بسازید، اما تعداد کل آجرها هرگز تغییر نمیکند.
اهمیت در موازنه معادلات شیمیایی
اینجاست که قانون پایستگی جرم به طور مستقیم به مبحث شیمی دهم و مفهوم موازنه گره میخورد:
موازنه کردن یک معادله شیمیایی به این معنی است که با قرار دادن ضرایب مناسب (اعداد بزرگ) در کنار فرمولهای شیمیایی، اطمینان حاصل کنیم که تعداد اتمهای هر عنصر در سمت واکنشدهندهها (سمت چپ) با تعداد اتمهای همان عنصر در سمت فرآوردهها (سمت راست) برابر باشد.
به عنوان مثال، معادله سوختن متان (CH۴):
| اتم | تعداد در واکنشدهندهها | تعداد در فرآوردهها |
|---|---|---|
| کربن | ۱ | ۱ |
| هیدروژن | ۴ | ۴ |
| اکسیژن | ۴ | ۴ |
نتیجه: چون تعداد اتمهای هر عنصر در دو طرف برابر است، پس قانون پایستگی جرم رعایت شده است.
درک کامل این قانون در شیمی دهم، برای یادگیری مبحث استوکیومتری حیاتی است. استوکیومتری در واقع هنر استفاده از معادله موازنه شده برای پیشبینی و محاسبه مقادیر کمی مواد در یک واکنش است.
اگر یک معادله موازنه نشده باشد، تعداد اتمها برابر نیست و در نتیجه، قانون پایستگی جرم نقض میشود.
اگر قانون پایستگی جرم نقض شود، محاسبات استوکیومتری (مانند محاسبه مقدار فرآوردهای که از یک مقدار واکنشدهنده خاص به دست میآید) کاملاً نادرست خواهد بود.
این اصل در مقاطع بالاتر نیز حفظ میشود و در مباحثی چون قانون هس (شیمی یازدهم) و حل مسائل پیچیده کنکور، به عنوان یک اصل ثابت و ابزاری قدرتمند برای تحلیل واکنشها، مورد استفاده قرار میگیرد.
نتیجهگیری: قانون پایستگی جرم صرفاً یک تعریف ساده نیست؛ بلکه یک چارچوب فکری است که به ما میگوید هیچ مادهای در عالم شیمی بیهوده هدر نمیرود و تمام مواد اولیه باید در قالب محصولات، قابل ردیابی باشند. این قانون، اساس تمام محاسبات شیمیایی دقیق و ستون اصلی علم شیمی نوین است.