در این مقاله، به بررسی جدول تناوبی و موقعیت عناصر میپردازیم. این مفاهیم بخش مهمی از فصل ۱ کتاب شیمی دهم هستند و درک آنها برای دانشآموزان پایه دهم ضروری است. با مطالعه این مقاله، بهراحتی میتوانید بر این مباحث مسلط شوید.
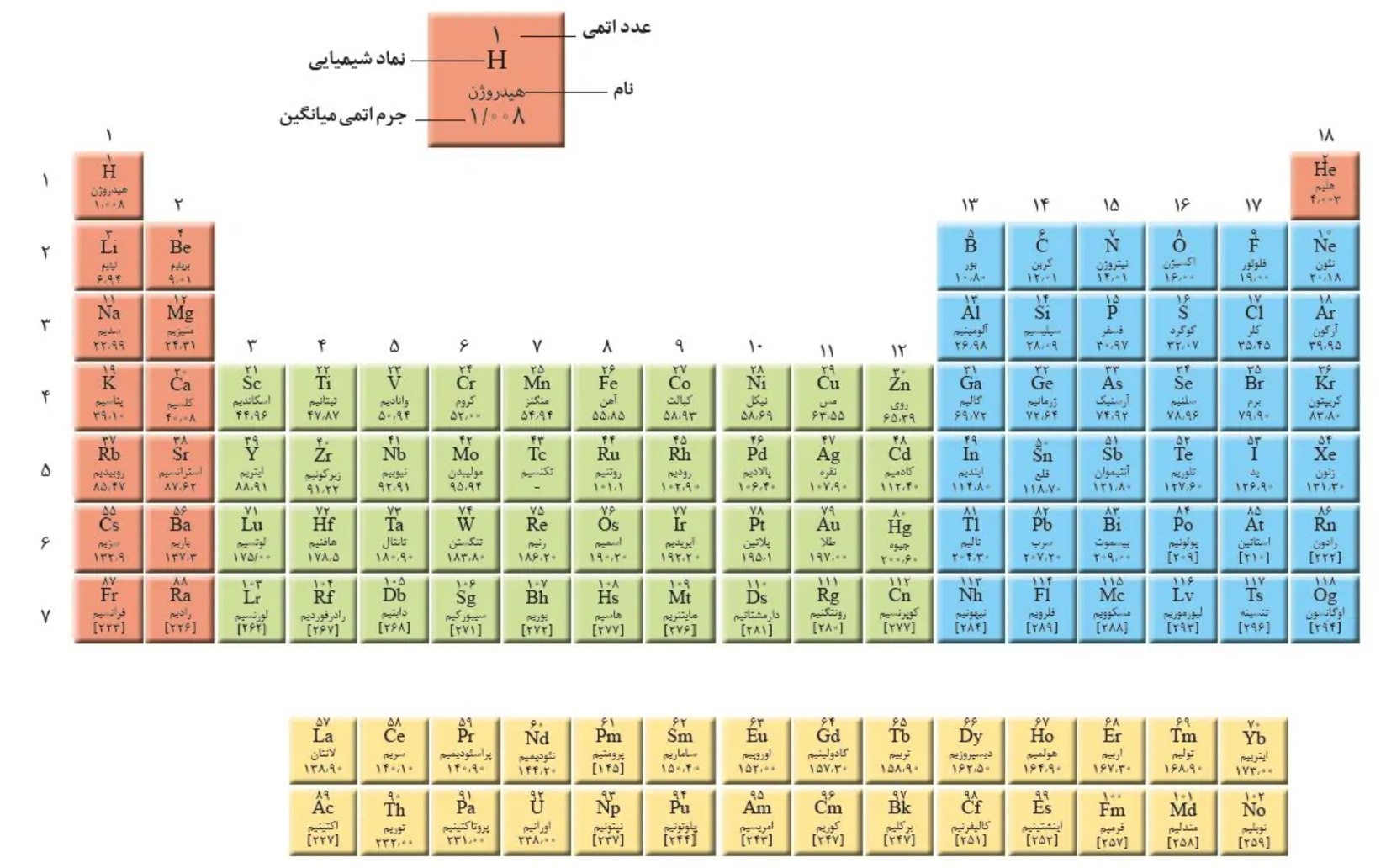
جدول تناوبی چیست؟
جدول تناوبی، ابزاری قدرتمند برای سازماندهی و پیشبینی ویژگیهای عناصر است. این جدول بر اساس عدد اتمی (تعداد پروتونها) و آرایش الکترونی عناصر مرتب شده است. هر عنصر در جدول تناوبی دارای یک دوره و یک گروه است.
توسعه جدول تناوبی توسط مندلیف، یکی از مهمترین رویدادها در تاریخچه شیمی بود که تحولی در طبقهبندی عناصر ایجاد کرد.
دوره و گروه در جدول تناوبی
دوره (ردیف افقی):
نشاندهنده تعداد لایههای الکترونی است.
مثال: عنصر سدیم (Na) در دوره ۳ قرار دارد، زیرا ۳ لایه الکترونی دارد.گروه (ستون عمودی):
نشاندهنده تعداد الکترونهای لایه ظرفیت است به جز عناصر دسته p .
یکان شماره گروه = الکترون های لایه ظرفیت
مثال: عنصر کلر (Cl) در گروه ۱۷ قرار دارد، زیرا ۷ الکترون در لایه ظرفیت دارد.
رابطه عدد اتمی با دوره و گروه
تعیین دوره از روی عدد اتمی:
شماره دوره برابر با شماره لایه ظرفیت است.
مثال: عنصر با عدد اتمی ۱۹ (پتاسیم) در دوره ۴ قرار دارد.تعیین گروه از روی عدد اتمی:
شماره گروه بر اساس تعداد الکترونهای لایه ظرفیت تعیین میشود به جز عناصر دسته p .
شماره گروه = p + ۱۲
مثال: عنصر با عدد اتمی ۱۷ (کلر) در گروه ۱۷ قرار دارد.
تعیین عدد اتمی از روی دوره و گروه
تعیین عدد اتمی از روی دوره:
عدد اتمی عنصر باید در محدوده عدد اتمی عناصر آن دوره باشد.
مثال: عنصر در دوره ۳ و گروه ۱، سدیم (Na) با عدد اتمی ۱۱ است.تعیین عدد اتمی از روی گروه:
عدد اتمی عنصر باید با تعداد الکترونهای لایه ظرفیت مطابقت داشته باشد.
مثال: عنصر در گروه ۱۸ و دوره ۲، نئون (Ne) با عدد اتمی ۱۰ است.
حل نمونه سوال
سوال ۱: عنصر با عدد اتمی ۲۰ در کدام دوره و گروه قرار دارد؟
پاسخ:
عدد اتمی ۲۰: کلسیم (Ca)
دوره: ۴ (چون ۴ لایه الکترونی دارد)
گروه: ۲ (چون ۲ الکترون در لایه ظرفیت دارد)
سوال ۲: عنصر در دوره ۵ و گروه ۱۵ را شناسایی کنید و عدد اتمی آن را بنویسید.
پاسخ:
عنصر: آنتیموان (Sb)
عدد اتمی: ۵۱
خلاصه این جلسه
جدول تناوبی عناصر بر اساس عدد اتمی و آرایش الکترونی مرتب شده است.
دوره نشاندهنده تعداد لایههای الکترونی و گروه نشاندهنده تعداد الکترونهای لایه ظرفیت است به جز عناصر دسته p .
میتوان دوره و گروه را از روی عدد اتمی و بالعکس تعیین کرد.
سوالات متداول
۱. دوره و گروه در جدول تناوبی چیست؟
دوره نشاندهنده تعداد لایههای الکترونی و گروه نشاندهنده تعداد الکترونهای لایه ظرفیت است به جز عناصر دسته p.
۲. چگونه عدد اتمی را از روی دوره و گروه پیدا کنیم؟
با استفاده از آرایش الکترونی و تعداد الکترونهای لایه ظرفیت.
۳. عناصر گروه ۱۸ چه ویژگیهایی دارند؟
گازهای نجیب هستند و لایه ظرفیت آنها کاملاً پر شده است.
برای مشاهده نمونه سوالات تستی کنکوری به قسمت حل تستهای کنکوری ساختار اتم | شیمی دهم مراجعه کنید

