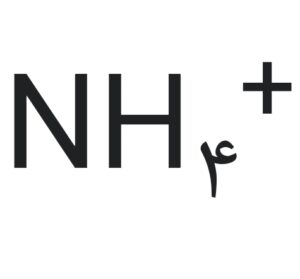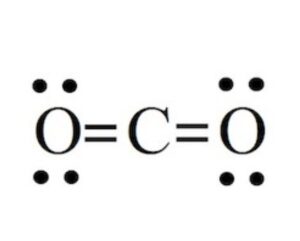در این مقاله، به بررسی ساختار لوییس و انواع ترسیم آن میپردازیم. این مفاهیم بخش مهمی از شیمی دهم هستند و درک آنها برای دانشآموزان پایه دهم ضروری است. با مطالعه این مقاله، بهراحتی میتوانید بر این مباحث مسلط شوید.
ساختار لوییس چیست؟
ساختار لوییس (Lewis Structure) روشی برای نمایش پیوندهای شیمیایی و آرایش الکترونهای ظرفیت در مولکولها و یونها است. این ساختارها به ما کمک میکنند تا نحوه اتصال اتمها به یکدیگر و توزیع الکترونها را درک کنیم. ساختار لوییس برای اولین بار توسط گیلبرت لوییس در سال ۱۹۱۶ معرفی شد و از آن زمان بهعنوان یکی از ابزارهای اصلی در شیمی برای نمایش پیوندهای شیمیایی استفاده میشود.
ساختار لوییس: کلید درک پیوندهای شیمیایی
ساختار لوییس یکی از ابزارهای مهم در شیمی است که به دانشآموزان کمک میکند تا نحوه اتصال اتمها به یکدیگر و توزیع الکترونها در مولکولها و یونها را درک کنند. این ساختارها نهتنها در کتابهای درسی، بلکه در دنیای واقعی نیز کاربردهای فراوانی دارند. مثلاً، آیا میدانستید که ساختار لوییس به دانشمندان کمک کرده است تا نحوه تشکیل مولکولهای حیاتی مانند DNA و پروتئینها را درک کنند؟
چرا ساختار لوییس مهم است؟
ساختار لوییس به ما کمک میکند تا:
پیوندهای شیمیایی بین اتمها را درک کنیم.
شکل مولکولها را پیشبینی کنیم.
واکنشهای شیمیایی را بهتر تحلیل کنیم.
خواص فیزیکی و شیمیایی مواد را بررسی کنیم.
نکات جذاب درباره ساختار لوییس
اتمها دوست دارند کامل باشند!
اتمها بهطور طبیعی تمایل دارند لایه ظرفیت خود را با الکترونها پر کنند تا به حالت پایدار برسند. این همان قاعده اکتت است که میگوید اتمها دوست دارند ۸ الکترون در لایه ظرفیت خود داشته باشند (به جز هیدروژن که فقط ۲ الکترون نیاز دارد).پیوندها مانند دستهای دوستی هستند!
وقتی اتمها الکترونهای خود را به اشتراک میگذارند، یک پیوند کووالانسی تشکیل میشود. این پیوندها مانند دستهای دوستی هستند که اتمها را به هم متصل میکنند.ساختارهای رزونانسی: چند چهرهی یک مولکول!
برخی مولکولها مانند O۳(اوزون) بیش از یک ساختار لوییس معتبر دارند. به این ساختارها ساختارهای رزونانسی میگویند. این مولکولها مانند بازیگرانی هستند که میتوانند چندین نقش مختلف را بازی کنند!- ترکیبات یونی با آنتالپی فروپاشی شبکه بالا معمولاً ساختارهای لوییس سادهتری دارند.
مراحل رسم ساختار لوییس
تعیین الکترونهای ظرفیت:
تعداد الکترونهای ظرفیت هر اتم را بر اساس گروه آن در جدول تناوبی مشخص کنید.محاسبه کل الکترونهای ظرفیت:
مجموع الکترونهای ظرفیت همه اتمها را محاسبه کنید. برای یونها، بار یون را به این تعداد اضافه یا کم کنید.تعیین اتم مرکزی:
اتمی که کمترین الکترونگاتیوی را دارد، معمولاً اتم مرکزی است.اتصال اتمها با پیوندهای یگانه:
اتمها را با پیوندهای یگانه به اتم مرکزی متصل کنید.توزیع الکترونهای باقیمانده:
الکترونهای باقیمانده را به صورت جفتهای ناپیوندی روی اتمها قرار دهید.بررسی قاعده اکتت:
مطمئن شوید که همه اتمها (به جز هیدروژن) قاعده اکتت را رعایت میکنند.
انواع ترسیم ساختار لوییس
۱. ساختار لوییس برای مولکولهای خنثی
در این نوع، تعداد الکترونهای ظرفیت برابر با مجموع الکترونهای ظرفیت اتمها است.
مثال:
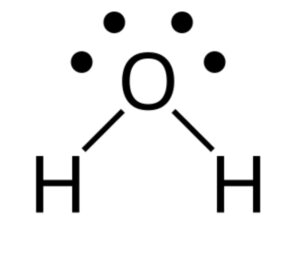
ترسیم ساختار لوییس برای مولکول آب (H۲O):
الکترونهای ظرفیت: H (۱ الکترون)، O (۶ الکترون)
کل الکترونهای ظرفیت: ۸=۶x۱)+(۱x۲))
ساختار لوییس:
۲. ساختار لوییس برای یونها
در این نوع، تعداد الکترونهای ظرفیت با توجه به بار یون تغییر میکند.
مثال:
ترسیم ساختار لوییس برای یون آمونیوم:
الکترونهای ظرفیت: N (۵ الکترون)، H (۱ الکترون)
کل الکترونهای ظرفیت: یک ۸ = ۵x۱) + (۱x۴) -۱) (بار مثبت یک الکترون کم میکند)
- ساختار لوییس:
۳. ساختار لوییس برای مولکولهای چنداتمی
در این نوع، ممکن است نیاز به رسم ساختارهای رزونانسی باشد.
مثال:
ترسیم ساختار لوییس برای مولکول CO۲:
الکترونهای ظرفیت: C (۴ الکترون)، O (۶ الکترون)
کل الکترونهای ظرفیت: ۱۶ = ۴x۱) + (۶x۲))
- ساختار لوییس:
نکات کنکوری ساختار لوییس
قاعده اکتت:
همه اتمها (به جز هیدروژن) باید ۸ الکترون در لایه ظرفیت خود داشته باشند.پیوندهای چندگانه:
اگر اتم مرکزی به قاعده اکتت نرسد، میتوان از پیوندهای دوگانه یا سهگانه استفاده کرد.رزونانس:
در برخی مولکولها، بیش از یک ساختار لوییس معتبر وجود دارد که به آنها ساختارهای رزونانسی میگویند.خلاصهی این جلسه
ساختار لوییس روشی برای نمایش پیوندهای شیمیایی و آرایش الکترونهای ظرفیت است.
با یادگیری مراحل رسم ساختار لوییس، میتوانید بهراحتی ساختار مولکولها و یونها را ترسیم کنید.
سوالات متداول
۱. قاعده اکتت چیست؟
قاعدهای که میگوید همه اتمها (به جز هیدروژن) باید ۸ الکترون در لایه ظرفیت خود داشته باشند.
۲. چگونه اتم مرکزی را تشخیص دهیم؟
اتمی که کمترین الکترونگاتیوی را دارد، معمولاً اتم مرکزی است.
۳. ساختارهای رزونانسی چه هستند؟
ساختارهایی که بیش از یک آرایش معتبر برای الکترونها دارند.