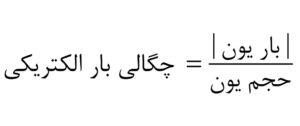فصل سوم شیمی دوازدهم یکی از مفهومی ترین مباحث شیمی به نام آنتالپی فروپاشی شبکه یونی را داره که با توجه به چگالی بار یون ها و رابطه مستقیمی که با آنتالپی فروپاشی شبکه یونی داره میتونیم حتی دمای ذوب ترکیبات یونی را هم مقایسه کنیم یادتون نره که خود چگالی بار با بار یون رابطه مستقیم و با شعاع یون رابطه وارونه داره تحلیل مهمی داره این تست و نمونه پرتکرار تست های این بخش را به خودش اختصاص میده به دقت مراحل تحلیل تست را ببینید
همانطور که در بحث انرژی یونش مشاهده میکنید، این دو مفهوم مکمل یکدیگر در تحلیل پایداری ترکیبات یونی هستند.
آنتالپی فروپاشی شبکه یونی چیست؟
یکی از مفهومیترین مباحث فصل سوم شیمی دوازدهم، مبحث آنتالپی فروپاشی شبکه یونی است. این مفهوم پایهای برای درک پایداری ترکیبات یونی، مقایسهی دمای ذوب آنها و تحلیل رفتار مواد در سطح ساختار بلوری است.
آنتالپی فروپاشی شبکه یونی به زبان ساده، انرژی مورد نیاز برای جدا کردن یک مول از یونهای سازندهی یک ترکیب یونی جامد و تبدیل آنها به یونهای گازی در شرایط استاندارد است. این انرژی به صورت عددی همیشه مثبت است، چون فرآیند فروپاشی نیاز به جذب انرژی دارد همینطور محاسبه آنتالپی فروپاشی با استفاده از قانون هس امکانپذیر است.
“این مفهوم ارتباط تنگاتنگی با انرژی یونش دارد.”
چرا آنتالپی شبکه مهم است؟
آنتالپی شبکه مشخص میکند که یونها با چه شدتی به یکدیگر جذب شدهاند. هرچه این انرژی بیشتر باشد، ترکیب یونی پایدارتر است و دمای ذوب بالاتری دارد.
بنابراین، آنتالپی شبکه:
نشاندهندهی پایداری ترکیب یونی
مرتبط با دمای ذوب، سختی و قابلیت حل شدن ترکیب
عاملی کلیدی در تحلیل تستهای کنکور
عوامل مؤثر بر آنتالپی فروپاشی شبکه یونی
۱. بار یونها (رابطه مستقیم)
هرچه بار مثبت یا منفی یونها بیشتر باشد، نیروی الکترواستاتیکی بین آنها قویتر است. مثلاً (+Mg(۲ نسبت به (+۱)Na بار بیشتری دارد، در نتیجه ترکیباتی که یونهای دو ظرفیتی یا سه ظرفیتی دارند، آنتالپی شبکه بیشتری هم دارند.
۲. شعاع یونها (رابطه وارونه)
یونهای کوچکتر به یکدیگر نزدیکتر هستند، بنابراین نیروهای جاذبه قویتری بین آنها شکل میگیرد. در نتیجه، آنتالپی شبکه افزایش مییابد.
چگالی بار یون: کلید مقایسه یونها
برای سادهتر کردن مقایسهها، مفهوم چگالی بار یون تعریف میشود:
این مفهوم به ما کمک میکند که بفهمیم یک یون چقدر قدرت جذب دارد. هرچه چگالی بار بیشتر باشد، یون تمایل بیشتری به تشکیل ساختار شبکهای پایدار دارد.
آنتالپی شبکه و دمای ذوب چه ارتباطی دارند؟
ارتباط بین این دو کاملاً مستقیم است:
ترکیباتی که آنتالپی شبکه بالاتری دارند، به دلیل نیروی جاذبه قویتر بین یونها، برای ذوب شدن به انرژی بیشتری نیاز دارند.
بنابراین، آنتالپی شبکه بالا → دمای ذوب بالا
به همین دلیل است که ترکیبی مثل MgO که یونهای پر بار و کوچک دارد، دمای ذوب بسیار بالاتری نسبت به ترکیبی مثل NaCl دارد.
تحلیل تست آنتالپی فروپاشی شبکه یونی | گام به گام
این مبحث یکی از پرتکرارترین بخشها در تستهای کنکور و آزمونهای آزمایشی است. برای حل تستهای مربوط به آنتالپی شبکه، مراحل زیر را طی کنید:
مرحله ۱: یونهای موجود را شناسایی کنید.
مثلاً در ترکیبهای CaO و BaO، یونهای کلسیم و باریم را مقایسه کنید.
مرحله ۲: بار یونها را مشخص کنید.
یون (+Ca(۲ و (+Ba(۲ هردو دو بار مثبت دارند.
مرحله ۳: شعاع یونها را مقایسه کنید.
(+Ba(۲ از (+Ca(۲ شعاع بزرگتری دارد ←چگالی بار کمتری دارد.
نتیجه:
CaO آنتالپی شبکه بیشتری دارد ←دمای ذوب بالاتری نیز خواهد داشت.
دامهای رایج در تستهای این بخش
فقط به بار یون توجه نکنید، چون اگر یون کوچکتر باشد، حتی با بار کمتر، میتواند آنتالپی شبکه زیادی داشته باشد.
مراقب باشید اگر دو یون بار مساوی دارند، مقایسه شعاع ملاک اصلی است.
برخی تستها ترکیبهایی میدهند که از نظر شعاع بسیار به هم نزدیکاند؛ در اینجا باید دقیقتر تحلیل شود.
نکات طلایی برای تستزنی:
یونهای با چگالی بار بالا ← آنتالپی شبکه بالا ← دمای ذوب بالا
ترتیب ترکیبهای پرتکرار از نظر آنتالپی شبکه:
MgO > CaO > NaCl > KBr
ترکیبات یونی با فلزات قلیایی خاکی معمولاً آنتالپی بالاتری دارند.
جمعبندی نهایی مقاله
آنتالپی فروپاشی شبکه یونی مفهومی کلیدی برای درک رفتار ترکیبات یونی است که در تحلیل دمای ذوب، پایداری بلور، و حتی انحلالپذیری اهمیت دارد. با دانستن چگالی بار یونها میتوان ترکیبها را بدون حفظ کردن اعداد مقایسه کرد و بسیاری از تستهای این بخش را مفهومی و سریع پاسخ داد.