تعریف پیوند یونی
پیوند یونی یکی از اصلیترین پیوندهای شیمیایی است که نقش زیادی در ایجاد ترکیبات معدنی و مواد پرکاربرد زندگی روزمره دارد. این پیوند بر اساس انتقال الکترون میان اتمها شکل میگیرد. وقتی یک اتم تمایل دارد الکترون از دست بدهد و اتم دیگری به دنبال دریافت آن الکترون باشد، انتقال رخ میدهد و دو یون با بار مخالف ایجاد میشوند. نیروی جاذبهی الکتریکی میان این یونهای مثبت و منفی باعث تشکیل پیوند یونی میشود.
اگر دانشآموز پایه دهم هستید، این مبحث را با معلم خصوصی شیمی پایه دهم به طور کامل یاد میگیرید. همچنین برای دید کلیتر و حرفهایتر میتوانید از تدریس تحصصی شیمی استفاده کنید.
روند تشکیل پیوند یونی
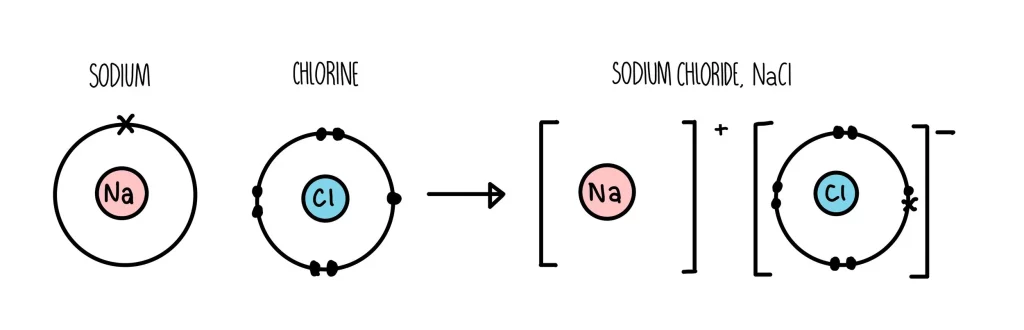
برای سادهتر شدن موضوع، مثال کلاسیک سدیم و کلر را بررسی میکنیم:
اتم سدیم Na در لایهی آخر خود تنها یک الکترون دارد. با از دست دادن این الکترون، سدیم به یون (+Na(۱ تبدیل میشود.
اتم کلر Cl در لایهی آخر خود هفت الکترون دارد. با گرفتن یک الکترون، کلر به یون (-Cl(۱ تبدیل میشود.
این دو یون با بار مخالف به شدت یکدیگر را جذب میکنند و ترکیب کلرید سدیم NaCl یا همان نمک خوراکی تشکیل میشود.
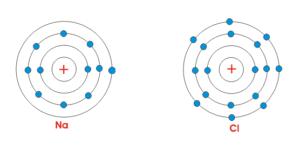
این الگو تقریبا در همهی ترکیبات یونی دیده میشود؛ یعنی یک فلز الکترون میدهد و یک نافلز آن را میگیرد.
ترکیب اکسید منیزیم MgO:
اتم منیزیم Mg دو الکترون از دست میدهد و یون Mg(۲+) را تشکیل میدهد.
اتم اکسیژن O دو الکترون میگیرد و به یون O(۲-) تبدیل میشود.
نیروی جاذبهی بین Mg(۲+) و O(۲-) پیوند یونی بسیار قوی در اکسید منیزیم ایجاد میکند
عوامل موثر بر قدرت پیوند یونی
پیوند یونی نیروی جاذبهای است که بین یونهای با بار مخالف (کاتیون مثبت و آنیون منفی) ایجاد میشود. شدت و قدرت این پیوند به دو عامل اصلی بستگی دارد: بار یونها و اندازهی یونها. هرچه بار یونها بیشتر باشد، نیروی جاذبه بین آنها قویتر میشود. همچنین، هرچه شعاع یونها کوچکتر باشد، یونها به یکدیگر نزدیکتر شده و پیوند محکمتر خواهد شد. به عبارت دیگر، یک یون کوچک با بار زیاد میتواند پیوند یونی بسیار قوی ایجاد کند، در حالی که یک یون بزرگ با بار کم نیروی جاذبه ضعیفتری خواهد داشت. این عوامل نه تنها بر استحکام بلورهای یونی تاثیر میگذارند، بلکه خواص فیزیکی مانند نقطه ذوب، سختی و شکنندگی مواد یونی را نیز تعیین میکنند.
پیوندهای یونی معمولاً بین فلزات و نافلزات شکل میگیرند. فلزها، که معمولاً از گروههای ۱ و ۲ جدول تناوبی (alkali metals و alkaline earth metals) هستند، الکترون(های) خارجی خود را از دست میدهند و به کاتیون مثبت تبدیل میشوند. از طرف دیگر، نافلزات که اغلب از گروههای 16 و 17 جدول تناوبی (chalcogens و halogens) هستند، این الکترونها را جذب میکنند و به آنیون منفی تبدیل میشوند. این انتقال الکترون باعث ایجاد یونهای با بار مخالف میشود که به واسطهی نیروی الکترواستاتیکی به یکدیگر جذب میشوند و پیوند یونی شکل میگیرد. به همین دلیل معمولاً ترکیبات یونی بین فلزات با نافلزات ساخته میشوند، مانند سدیم کلرید NaCl که یک نمونه کلاسیک است.
ویژگیهای ترکیبات یونی
ترکیبات یونی به دلیل نوع پیوندشان، خواص ویژهای دارند:
نقطه ذوب و جوش بالا ←
به علت جاذبه قوی بین یونها.بلورهای منظم←
مانند شبکهی بلوری NaCl.رسانایی الکتریکی در حالت مذاب یا محلول ←
چون یونها میتوانند آزادانه حرکت کنند.حلالیت در آب ←
بسیاری از ترکیبات یونی بهراحتی در آب حل میشوند.
کاربردهای پیوند یونی در زندگی و صنعت
پیوند یونی فقط یک مفهوم کتابی نیست، بلکه بخش مهمی از دنیای واقعی ماست:
NaCl (نمک خوراکی): ضروری برای بدن و مواد غذایی.
MgO (اکسید منیزیم): کاربرد در صنایع نسوز.
CaCl۲ (کلرید کلسیم): استفاده در یخزدایی و صنایع شیمیایی.
KCl (کلرید پتاسیم): مورد استفاده در پزشکی و کشاورزی.
این نمونهها نشان میدهند که بدون درک پیوند یونی، فهم کاربردهای شیمی تقریبا غیرممکن است.
تفاوت پیوند یونی و کووالانسی
گرچه پیوند یونی و پیوند کووالانسی هر دو از انواع پیوندهای شیمیایی هستند، اما تفاوت اساسی دارند:
در پیوند یونی، الکترونها از یک اتم به اتم دیگر منتقل میشوند.
در پیوند کووالانسی، الکترونها به صورت مشترک استفاده میشوند.
به همین دلیل، خواص ترکیبات یونی و کووالانسی کاملا متفاوت است. مثلا ترکیبات یونی بلوری و رسانا هستند، اما ترکیبات کووالانسی معمولا نرمتر بوده و رسانایی ندارند.
جمعبندی
پیوند یونی بر پایهی انتقال الکترونها و ایجاد یونهای مثبت و منفی شکل میگیرد. این پیوند ویژگیهایی مانند رسانایی در محلول، بلورهای منظم و نقطه ذوب بالا دارد و در بسیاری از ترکیبات مهم زندگی ما دیده میشود.