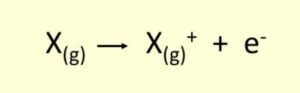انرژی یونش (Ionization Energy) یکی از مفاهیم بنیادی در شیمی است که به بررسی میزان پایداری الکترونها در اتمها و مولکولها میپردازد. این پارامتر نه تنها به درک خواص فیزیکی و شیمیایی عناصر کمک میکند، بلکه نقش مهمی در توضیح واکنشپذیری و تشکیل پیوندهای شیمیایی دارد.
تعریف انرژی یونش
انرژی یونش به حداقل انرژی لازم برای جدا کردن یک الکترون از یک اتم خنثی در حالت گازی اشاره دارد . این فرآیند به صورت زیر نشان داده میشود:
در این معادله:
- X(g): اتم خنثی در حالت گازی.
- X⁺(g): یون مثبت (کاتیون) حاصل از جدا شدن یک الکترون.
- ⁻e: الکترون جدا شده.
انرژی یونش معمولاً به واحد کیلوژول بر مول (kJ/mol) بیان میشود. این مقدار نشاندهنده میزان انرژی لازم برای غلبه بر نیروی جاذبه بین هسته و الکترونها است.
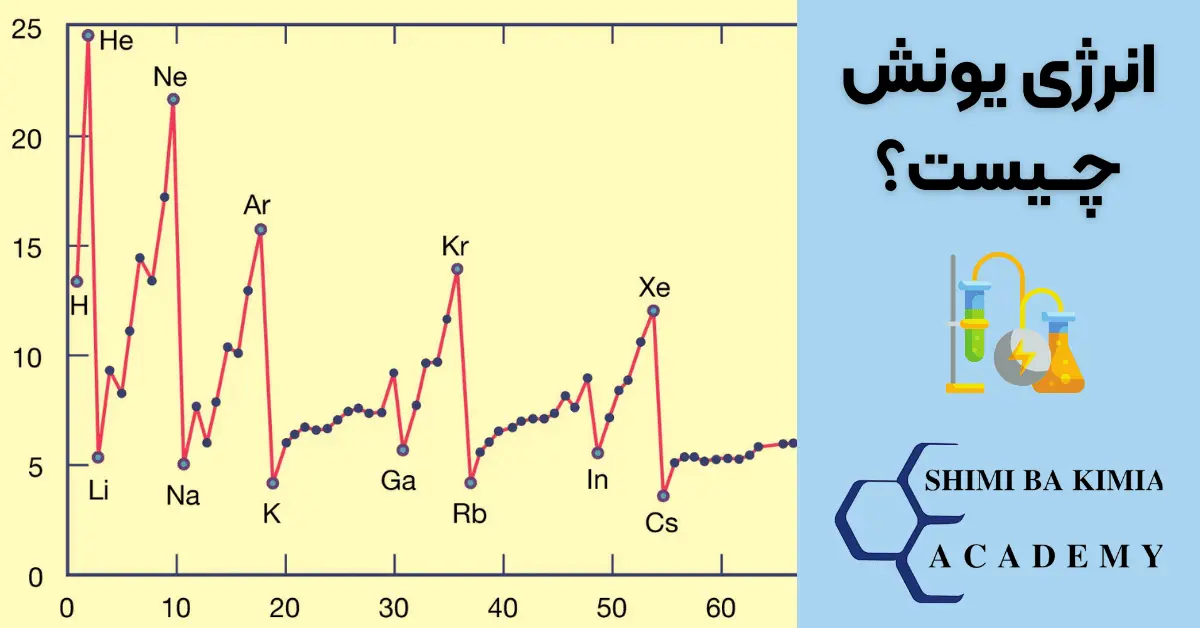
روند انرژی یونش در جدول تناوبی به صورت دورهای تغییر میکند.
به طور کلی، انرژی یونش با جدا کردن هر الکترون اضافی افزایش مییابد، زیرا الکترونهای باقیمانده به طور محکمتری به هسته متصل میشوند.
گازهای نجیب به دلیل پایداری آرایش الکترونی، بالاترین انرژی یونش را دارند
انواع انرژی یونش
- انرژی یونش اول : انرژی لازم برای جدا کردن اولین الکترون از یک اتم خنثی.
- انرژی یونش دوم : انرژی لازم برای جدا کردن دومین الکترون از یک اتم که قبلاً یک الکترون از دست داده است.
- انرژی یونش سوم و بالاتر : انرژی لازم برای جدا کردن الکترونهای بعدی.
اهمیت انرژی یونش در شیمی
1. تشکیل پیوندهای شیمیایی
- انرژی یونش به درک نحوه تشکیل پیوندهای یونی و کووالانسی کمک میکند.
- اتمهایی با انرژی یونش کم (مانند فلزات قلیایی) تمایل بیشتری به از دست دادن الکترون و تشکیل یون مثبت دارند.
- اتمهایی با انرژی یونش بالا (مانند غیرفلزات) تمایل بیشتری به جذب الکترون و تشکیل یون منفی دارند.
2. تعیین خواص عنصرها
- انرژی یونش نقش مهمی در تعیین خواص فلزی و غیرفلزی عناصر دارد.
- فلزات معمولاً انرژی یونش کمتری دارند و به راحتی الکترون از دست میدهند.
- غیرفلزات انرژی یونش بیشتری دارند و تمایل کمتری به از دست دادن الکترون دارند.
3. پیشبینی واکنشپذیری عناصر
- انرژی یونش به ما کمک میکند تا واکنشپذیری عناصر را پیشبینی کنیم.
- عناصری با انرژی یونش کمتر، واکنشپذیری بیشتری دارند و به راحتی در واکنشهای شیمیایی شرکت میکنند.
4. تحلیل جدول تناوبی
- انرژی یونش به طور منظم در جدول تناوبی تغییر میکند:
- در یک گروه ، از بالا به پایین، انرژی یونش کاهش مییابد (به دلیل افزایش شعاع اتمی).
- در یک دوره ، از چپ به راست، انرژی یونش افزایش مییابد (به دلیل افزایش بار مؤثر هسته).
5. کاربردهای صنعتی
- در صنایع مختلف، انرژی یونش برای انتخاب مواد مناسب برای واکنشهای شیمیایی و تولید مواد جدید استفاده میشود.
- به عنوان مثال، در تولید فلزات، انرژی یونش به تعیین روشهای استخراج فلز از سنگ معدن کمک میکند.
6. طراحی مواد نوین
- در طراحی مواد نوین مانند نیمههادیها و مواد مغناطیسی، انرژی یونش نقش مهمی در تعیین خواص الکترونیکی و مغناطیسی مواد دارد.
نمونهای از کاربرد انرژی یونش
- فلزات قلیایی (مانند سدیم)
- سدیم (Na) انرژی یونش کمی دارد و به راحتی یک الکترون از دست میدهد. این ویژگی باعث میشود سدیم در واکنشهای شیمیایی به سرعت یون ⁺Na تشکیل دهد.
- گازهای نجیب (مانند هلیوم)
- هلیوم (He) انرژی یونش بسیار بالایی دارد و به دلیل پایداری الکترونیکیاش، تمایلی به از دست دادن یا جذب الکترون ندارد.
- نیتروژن و اکسیژن
- نیتروژن (N) انرژی یونش بیشتری نسبت به اکسیژن (O) دارد، زیرا نیتروژن دارای ساختار الکترونی پایدارتری است.
عوامل مؤثر بر انرژی یونش
- بار مؤثر هسته
- وقتی بار مؤثر هسته (Effective Nuclear Charge) افزایش مییابد، نیروی جاذبه بین هسته و الکترونها بیشتر میشود. در نتیجه، انرژی یونش افزایش مییابد.
- به عنوان مثال، در گروههای جدول تناوبی، وقتی از بالا به پایین حرکت میکنیم، بار مثبت هسته کاهش مییابد و انرژی یونش افزایش مییابد.
- شعاع اتمی
- اتمهایی با شعاع بزرگتر، الکترونهای خود را ضعیفتر نگه میدارند. بنابراین، انرژی یونش کمتری دارند.
- به عنوان مثال، در دورههای جدول تناوبی، وقتی از چپ به راست حرکت میکنیم، شعاع اتمی کاهش مییابد و انرژی یونش افزایش مییابد.
- لایههای الکترونی
- الکترونهای موجود در لایههای داخلی، الکترونهای لایه ظرفیت را از جاذبه هسته محافظت میکنند. این پدیده به “اثر پوششی” (Shielding Effect) معروف است.
- اتمهایی که تعداد لایههای الکترونی بیشتری دارند، انرژی یونش کمتری دارند.
- جفتالکترونهای جفتنشده
- اتمهایی که الکترونهای جفتنشده دارند، تمایل کمتری به از دست دادن الکترون دارند. بنابراین، انرژی یونش آنها بیشتر است.
مثالهایی از انرژی یونش
- مقایسه انرژی یونش در گروهها
- در گروه ۱ (فلزات قلیایی)، انرژی یونش از بالا به پایین کاهش مییابد. به عنوان مثال، انرژی یونش لیتیم (Li) بیشتر از سدیم (Na) است.
- مقایسه انرژی یونش در دورهها
- در دوره ۲، انرژی یونش از لیتیم (Li) تا نئون (Ne) افزایش مییابد. این افزایش به دلیل افزایش بار مؤثر هسته و کاهش شعاع اتمی است.
- استثناها
- گاهی اوقات، انرژی یونش به دلیل پایداری خاص ساختار الکترونی، افزایش مییابد. به عنوان مثال، نیتروژن (N) انرژی یونش بیشتری نسبت به اکسیژن (O) دارد، زیرا نیتروژن دارای ساختار الکترونی پایدارتری است.
رابطه انرژی یونش با ساختار اتم و جدول تناوبی
۱. رابطه با ساختار اتم:
- بار هسته (عدد اتمی):
با افزایش بار مثبت هسته، جاذبه به الکترونهای لایه ظرفیت بیشتر شده و انرژی یونش افزایش مییابد.
مثال: انرژی یونش سدیم (۱۱ پروتون) < منیزیم (۱۲ پروتون) - شعاع اتمی:
اتمهای کوچکتر الکترونها را محکمتر نگه میدارند، بنابراین انرژی یونش بالاتری دارند.
مثال: انرژی یونش فلوئور (شعاع کوچک) > ید (شعاع بزرگ) - اثر پوششی الکترونهای داخلی:
الکترونهای لایههای داخلی مانند “پوشش” عمل کرده و جاذبه هسته به الکترون ظرفیت را کاهش میدهند.
مثال: انرژی یونش لیتیم (۲ لایه الکترونی) > سدیم (۳ لایه)
۲. روندهای جدول تناوبی:
الف) در یک دوره (ردیف افقی):
- از چپ به راست انرژی یونش افزایش مییابد.
- دلیل: افزایش بار هسته بدون افزایش قابل توجه شعاع اتمی
- استثنا: انرژی یونش اکسیژن (۲۴٫۵ الکترون ولت) < نیتروژن (۲۵٫۵ الکترون ولت) به دلیل پایداری نیمهپر بودن اوربیتال p در نیتروژن (۲p³)
ب) در یک گروه (ستون عمودی):
- از بالا به پایین انرژی یونش کاهش مییابد.
- دلیل: افزایش شعاع اتمی و اثر پوششی قویتر
- مثال:
لیتیم (۵۲۰ کیلوژول بر مول) > سدیم (۴۹۶ کیلوژول بر مول) > پتاسیم (۴۱۹ کیلوژول بر مول)
۳. نمودار انرژی یونش برای یک اتم:
- اولین انرژی یونش < دومین انرژی یونش < …
- جهش بزرگ: هنگام حذف الکترون از لایه پایینتر
مثال: منیزیم (اولین: ۷۳۸ کیلوژول بر مول، دومین: ۱۴۵۱ کیلوژول بر مول)
۴. کاربرد این روابط:
- پیشبینی عدد اکسایش عناصر
- توضیح واکنشپذیری فلزات و نافلزات
- طراحی مواد با خواص الکترونی خاص
جمعبندی بصری:
| عامل | تأثیر بر انرژی یونش | مثال جدولی |
|---|---|---|
| افزایش بار هسته | افزایش | سدیم → منیزیم → آلومینیوم |
| افزایش شعاع | کاهش | لیتیم → سدیم → پتاسیم |
| اثر پوششی | کاهش | گروه ۱ (فلزات قلیایی) |
این روابط به شیمیدانان کمک میکند رفتار عناصر را پیشبینی کنند، مثلاً:
- چرا فلزات قلیایی بسیار واکنشپذیرند؟ (انرژی یونش بسیار پایین)
- چرا گازهای نجیب واکنش نمیدهند؟ (انرژی یونش بسیار بالا)
مقایسه آنتالپی فروپاشی شبکه با انرژی یونش عناصر، الگوهای جالبی در پایداری ترکیبات یونی نشان میدهد.
سوالات متداول (FAQ)
۱. چرا انرژی یونش دوم همیشه بیشتر از انرژی یونش اول است؟
پس از جدا شدن اولین الکترون، بار مؤثر هسته روی الکترونهای باقیمانده افزایش مییابد و اتم کوچکتر میشود. در نتیجه، انرژی بیشتری برای جدا کردن الکترون بعدی لازم است.
مثال:
- منیزیم (Mg):
- اولین انرژی یونش: ۷۳۸ kJ/mol
- دومین انرژی یونش: ۱۴۵۱ kJ/mol
۲. کدام عنصر بالاترین انرژی یونش اول را دارد؟
هلیوم (He) با انرژی یونش ۲۳۷۲ kJ/mol، چون کوچکترین اندازه و بالاترین بار مؤثر هسته را دارد.
۳. چگونه انرژی یونش بر رسانایی الکتریکی فلزات تأثیر میگذارد؟
فلزاتی با انرژی یونش پایین (مانند مس، طلا، آلومینیوم) به راحتی الکترون آزاد میکنند و رسانای خوبی هستند. برعکس، عناصری با انرژی یونش بالا (مانند کربن در حالت الماس) رسانایی کمی دارند.
۴. آیا انرژی یونش با الکترونگاتیوی یکسان است؟
خیر! الکترونگاتیوی تمایل اتم به جذب الکترون در پیوند است، اما انرژی یونش به جداسازی الکترون از اتم منفرد اشاره دارد.
۵. کاربرد انرژی یونش در صنعت نیمههادیها چیست؟
در ساخت ترانزیستورها و مدارهای الکترونیکی، کنترل انرژی یونش عناصر (مانند سیلیسیم و ژرمانیم) به تنظیم هدایت الکتریکی کمک میکند.
جمعبندی
انرژی یونش یک معیار کلیدی برای درک واکنشپذیری عناصر، نوع پیوندهای شیمیایی، و خواص فیزیکی مواد است. این مفهوم در شیمی، فیزیک اتمی، علوم مواد، و حتی اخترفیزیک کاربردهای حیاتی دارد. انرژی یونش نه تنها در پیشبینی رفتار عناصر، بلکه در صنایع پیشرفته (نظیر نانوذرات، لیزرها، و فناوری فضایی) کاربرد دارد. با درک این مفهوم، میتوان مواد جدیدی با خواص منحصر به فرد طراحی کرد یا واکنشهای شیمیایی را بهینه ساخت.