یکی از مباحث پایهای و بسیار مهم در شیمی دهم شناخت یونها، بهویژه کاتیونها و آنیونهاست. درک درست این موضوع به شما کمک میکند مباحث بعدی مثل واکنشهای شیمیایی، استوکیومتری و حتی مسائل مربوط به اسید و باز را راحتتر متوجه شوید. اگر در یادگیری این بخش مشکل دارید، پیشنهاد میکنم به صفحهی تدریس خصوصی شیمی دهم سر بزنید تا بتوانید با کمک معلم خصوصی این مبحث را بهصورت عمیقتر و با مثالهای متنوع یاد بگیرید.
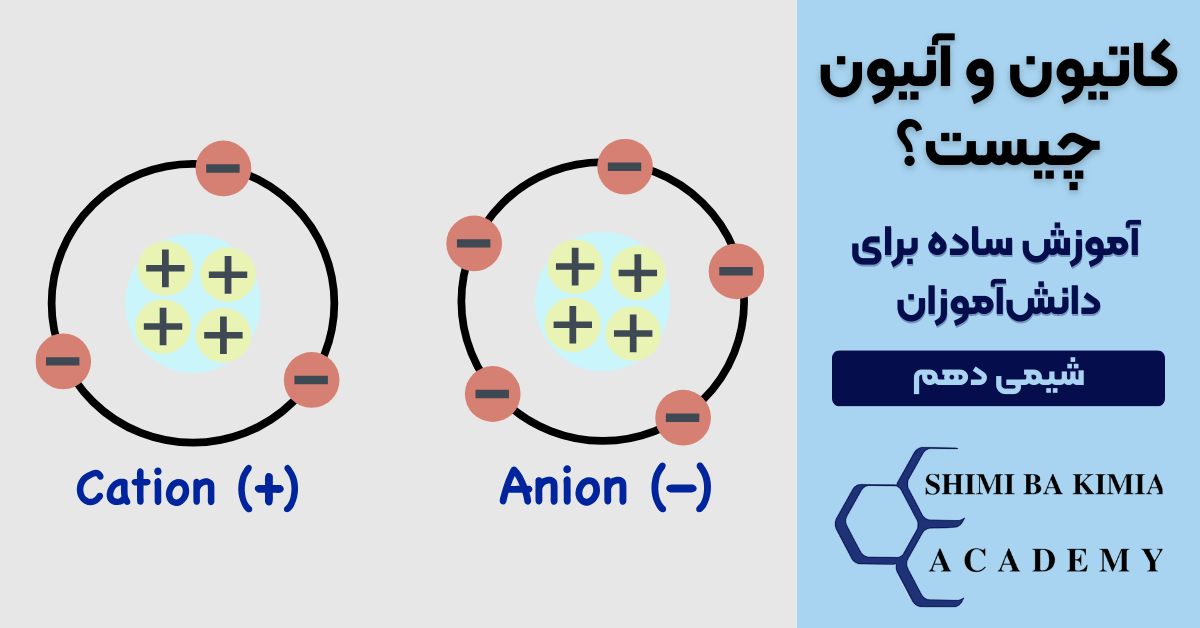
کاتیون و آنیون چیست؟
یکی از مهمترین مفاهیمی که در شیمی پایه و بهویژه در دروس دبیرستان و دانشگاهی مطرح میشود، موضوع یونها است. یونها در حقیقت اتمها یا گروهی از اتمها هستند که به دلیل از دست دادن یا بهدست آوردن الکترون، بار الکتریکی پیدا میکنند. وقتی درباره یونها صحبت میکنیم، دو واژهی بسیار کلیدی مطرح میشود: کاتیون و آنیون. درک درست این دو مفهوم نهتنها برای فهمیدن مباحث ساختار اتم ضروری است، بلکه در مباحث پیشرفتهتر مانند پیوندهای یونی، شیمی آلی ، الکتروشیمی و حتی زیستشیمی نیز اهمیت زیادی دارد.
مفهوم کلی یونها
یک اتم در حالت عادی دارای تعداد مساوی پروتون و الکترون است. پروتونها بار مثبت و الکترونها بار منفی دارند، بنابراین وقتی تعداد آنها برابر باشد، اتم خنثی خواهد بود. اما اگر اتمی یک یا چند الکترون را از دست بدهد یا به دست بیاورد، تعادل بار به هم میریزد. نتیجهی این تغییر، تشکیل یون است. یون میتواند مثبت یا منفی باشد و همینجاست که کاتیون و آنیون وارد ماجرا میشوند.
برای درک بهتر این موضوع، آشنایی با ذرات زیراتمی و ایزوتوپها بسیار کمککننده است، زیرا شناخت پروتون، نوترون و الکترون به ما نشان میدهد که تغییر در کدام بخش باعث تشکیل یون خواهد شد.
کاتیون چیست؟

کاتیون به یونهایی گفته میشود که بار مثبت دارند. این اتفاق زمانی رخ میدهد که یک اتم یک یا چند الکترون از دست بدهد. چون پروتونهای درون هسته از بین نمیروند، تعداد بارهای مثبت پروتونها بیشتر از بارهای منفی الکترونها میشود و در نتیجه یون دارای بار مثبت خواهد شد.
مثال:
اتم سدیم NA در حالت خنثی ۱۱ الکترون دارد. اگر یک الکترون از دست بدهد، تعداد پروتونها ۱۱ و تعداد الکترونها ۱۰ خواهد بود. در این حالت یون سدیم Na(۱+) بهوجود میآید که یک کاتیون است.
در فلزات قلیایی و قلیایی خاکی، کاتیونسازی بهراحتی رخ میدهد چون این عناصر تمایل دارند برای رسیدن به آرایش پایدار گاز نجیب، الکترونهای لایهی آخر خود را از دست بدهند.
کاتیونها در زندگی روزمره و صنعت بسیار اهمیت دارند. برای نمونه:
یون کلسیم (+Ca(۲ برای استحکام استخوانها ضروری است.
یون آهن Fe۲+) / (Fe۳+)) در انتقال اکسیژن توسط هموگلوبین نقش دارد.
کاتیونهای سدیم و پتاسیم برای انتقال پیامهای عصبی حیاتیاند.
آنیون چیست؟

در مقابل کاتیونها، آنیونها یونهایی هستند که بار منفی دارند. این بار منفی زمانی بهوجود میآید که یک اتم یک یا چند الکترون اضافه دریافت کند.
مثال:
اتم کلر (Cl) در حالت خنثی ۱۷ الکترون دارد. اگر یک الکترون دریافت کند، تعداد الکترونها ۱۸ و تعداد پروتونها ۱۷ خواهد بود. نتیجه این است که یون (-Cl(۱ یا همان آنیون کلرید تشکیل میشود.
هالوژنها مانند فلوئور، کلر، برم و ید بهراحتی آنیون تشکیل میدهند، چون تمایل شدیدی به گرفتن الکترون و رسیدن به قاعدهی اکتت دارند.
آنیونها نیز نقشهای فراوانی در شیمی و زیستشناسی دارند:
یون کلرید برای تعادل اسید و باز در بدن ضروری است.
یون سولفات در مواد معدنی و دارویی وجود دارد.
یون فسفات بخش مهمی از مولکول DNA است.
نقش کاتیون و آنیون در پیوند یونی
زمانی که یک کاتیون و یک آنیون با هم ترکیب میشوند، نیروی جاذبهی الکتریکی بین بارهای مخالف، آنها را کنار هم نگه میدارد و ترکیبی پایدار به نام پیوند یونی تشکیل میشود.
مثال کلاسیک این نوع پیوند، ترکیب سدیم Na(۱+) و کلرید Cl(۱+) است که نمک طعام (NaCl) را میسازد.
برای درک عمیقتر این پدیده، مطالعهی مدل اتمی بور و همچنین موضوع آرایش الکترونی آفبا کمک زیادی میکند.
کاتیونها و آنیونها در زندگی روزمره
شاید تصور کنیم یونها فقط در کتابهای شیمی وجود دارند، اما واقعیت این است که کاتیونها و آنیونها بخش جدانشدنی از زندگی ما هستند:
در بدن انسان: یون های سدیم و پتاسیم تنظیم فشار خون، انقباض عضلات و عملکرد عصبی را کنترل میکنند.
در کشاورزی: کودهای شیمیایی شامل یونهای نیترات ، فسفات و پتاسیم هستند.
در صنعت: فرایندهایی مثل الکترولیز فلزات و تولید باتری وابسته به یونهاست.
جمعبندی
کاتیون و آنیون در واقع دو روی یک سکهاند: یکی نتیجهی از دست دادن الکترون و دیگری نتیجهی به دست آوردن الکترون. درک این دو مفهوم پایهای به ما کمک میکند تا ساختار ترکیبات شیمیایی را بهتر بفهمیم و کاربردهای گسترده آنها در زندگی روزمره، پزشکی و صنعت را درک کنیم.