پیوندهای شیمیایی یکی از مباحث مهم در شیمی دبیرستان و کنکور هستند. اگر شما هم دانشآموز پایه دهم یا یازدهم هستید و یا قصد آمادگی برای تدریس خصوصی شیمی کنکور دارید، حتما باید مفهوم پیوندهای کووالانسی یا همان پیوندهای اشتراکی را بهخوبی یاد بگیرید. این مبحث در کنار پیوندهای یونی و فلزی، پایهایترین مفاهیم در شیمی ساختاری محسوب میشود.
تعریف پیوند کووالانسی
اتمها همواره به دنبال رسیدن به پایداری هستند. آنها تمایل دارند به حالتی برسند که تعداد الکترونهای لایه ظرفیتشان کامل شود. این حالت در شیمی به عنوان قاعده اکتت شناخته میشود. برای رسیدن به این پایداری، بعضی از اتمها الکترونهای خود را به اشتراک میگذارند. به همین دلیل است که پیوند کووالانسی شکل میگیرد.
در این پیوند، هر اتم بخشی از الکترونهای خود را در اختیار اتم دیگر قرار میدهد تا هر دو به پایداری برسند. به همین دلیل این نوع پیوند را اشتراکی هم مینامند.
چرا پیوند کووالانسی تشکیل میشود؟
پیوند کووالانسی زمانی شکل میگیرد که دو اتم برای رسیدن به آرایش پایدار، الکترونهای خود را به صورت اشتراکی به کار ببرند.
به عبارت دیگر، بهجای اینکه یک اتم الکترون بدهد و دیگری بگیرد (مانند پیوند یونی)، در پیوند کووالانسی هر دو اتم با هم شریک میشوند.
مثال ساده:
مولکول H۲ از دو اتم هیدروژن تشکیل شده است. هر اتم هیدروژن یک الکترون دارد. وقتی این دو اتم با هم پیوند میزنند، الکترونهایشان را به اشتراک میگذارند و هرکدام به آرایش پایدار هلیوم میرسند.
اگر میخواهید این مبحث را به صورت گامبهگام یاد بگیرید، پیشنهاد میکنم نگاهی هم به تدریس خصوصی شیمی دهم بیندازید؛ چون پیوند کووالانسی دقیقا از همین پایه بهطور مفصل آموزش داده میشود.
انواع پیوند کووالانسی
پیوندهای کووالانسی بر اساس تعداد جفتالکترونهای مشترک میتوانند متفاوت باشند:
پیوند کووالانسی یگانه: اشتراک یک جفت الکترون (مثال: H۲ یا Cl۲)
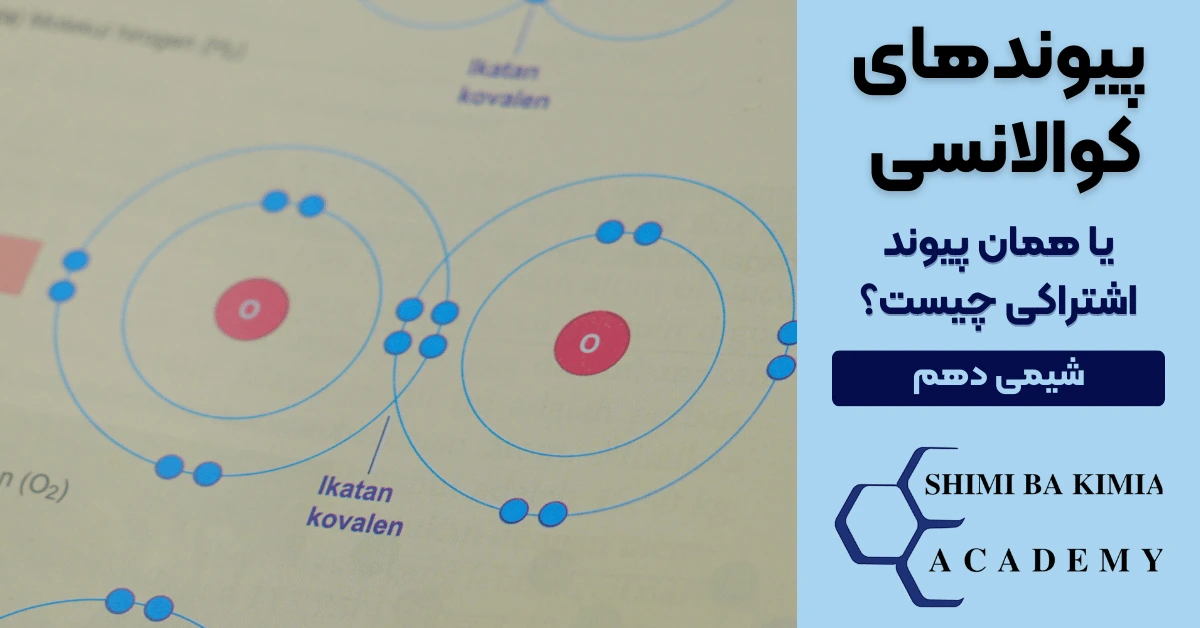
پیوند کووالانسی دوگانه: اشتراک دو جفت الکترون (مثال: O۲)
پیوند کووالانسی سهگانه: اشتراک سه جفت الکترون (مثال: N۲)
این تفاوت باعث تغییر در طول پیوند و انرژی آن میشود. مثلا هرچه تعداد جفتهای الکترونی بیشتر باشد، پیوند کوتاهتر و محکمتر است.
پیوند کووالانسی قطبی و غیرقطبی
پیوند کووالانسی غیرقطبی: اگر الکترونها بهطور مساوی بین دو اتم تقسیم شوند (مثلا H۲ یا Cl۲).
پیوند کووالانسی قطبی: اگر یکی از اتمها الکترونگاتیوتر باشد و سهم بیشتری از جفتالکترون مشترک داشته باشد (مثال: HCl).
مولکول آب (H۲O): هر اتم هیدروژن یک پیوند یگانه با اکسیژن دارد. این مولکول نمونهای از پیوندهای کووالانسی قطبی است.
دیاکسید کربن (CO۲): شامل دو پیوند دوگانه کووالانسی است.
آمونیاک (NH۳): یک مولکول با پیوندهای کووالانسی قطبی و جفتالکترون آزاد روی نیتروژن.
تفاوت پیوند کووالانسی و یونی
در پیوند یونی، الکترونها کاملا از یک اتم به اتم دیگر منتقل میشوند. برای مثال در ترکیب کلرید سدیم (NaCl)، سدیم یک الکترون از دست میدهد و کلر آن را دریافت میکند. در حالی که در پیوند کووالانسی، هیچ الکترونی از دست نمیرود بلکه بین دو اتم مشترک میشود.
این تفاوت بنیادی باعث میشود که خواص مواد یونی و کووالانسی بسیار متفاوت باشد. مواد یونی اغلب دارای نقطه ذوب و جوش بالا هستند و در حالت مذاب یا محلول رسانای جریان الکتریکیاند. اما بسیاری از ترکیبات کووالانسی مانند گازها و مایعات ساده چنین ویژگیهایی ندارند.
مثالهای روزمره از پیوند کووالانسی
برای درک بهتر، بیایید چند نمونه ساده را بررسی کنیم:
در مولکول آب، هر اتم هیدروژن با اکسیژن یک پیوند یگانه کووالانسی دارد.
در دیاکسید کربن، هر اتم اکسیژن با کربن یک پیوند دوگانه دارد.
در متان (CH۴)، کربن چهار پیوند کووالانسی یگانه با چهار اتم هیدروژن برقرار میکند.
این مثالها نشان میدهند که چگونه پیوند کووالانسی، پایه و اساس ترکیباتی است که ما هر روز با آنها زندگی میکنیم.
جمعبندی
پیوند کووالانسی یکی از مهمترین مفاهیم شیمی است که بدون آن، درک ساختار مواد و ترکیبات غیرممکن خواهد بود. این پیوندها با اشتراکگذاری الکترونها بین اتمها شکل میگیرند و اساس بسیاری از ترکیبات مهم در شیمی و زیستشناسی هستند. یادگیری درست این مبحث میتواند مسیر موفقیت شما در امتحانات و کنکور را هموار کند.
برای اینکه این موضوع و سایر مباحث شیمی را به طور کامل یاد بگیرید، تدریس خصوصی شیمی با استاد کیمیا بهترین گزینه است؛ چه در پایههای دهم، یازدهم و دوازدهم باشید و چه در حال آماده شدن برای کنکور.