مدل اتمی بور: تاریخچه، اصول و کاربردها
مدل اتمی بور یکی از مهمترین و تاثیرگذارترین نظریهها در تاریخ علم شیمی و فیزیک است. این مدل نهتنها توانست مشکل بزرگی را که مدل رادرفورد با آن روبهرو بود برطرف کند، بلکه برای نخستین بار توضیح داد که چرا هر عنصر طیف نوری منحصر به فردی دارد.
اگر به دنبال یادگیری عمیق شیمی هستید، میتوانید از تدریس خصوصی شیمی دهم یا کلاسهای عمومی شیمی بهره ببرید تا درک مفاهیم پایهای مدل بور راحتتر شود.
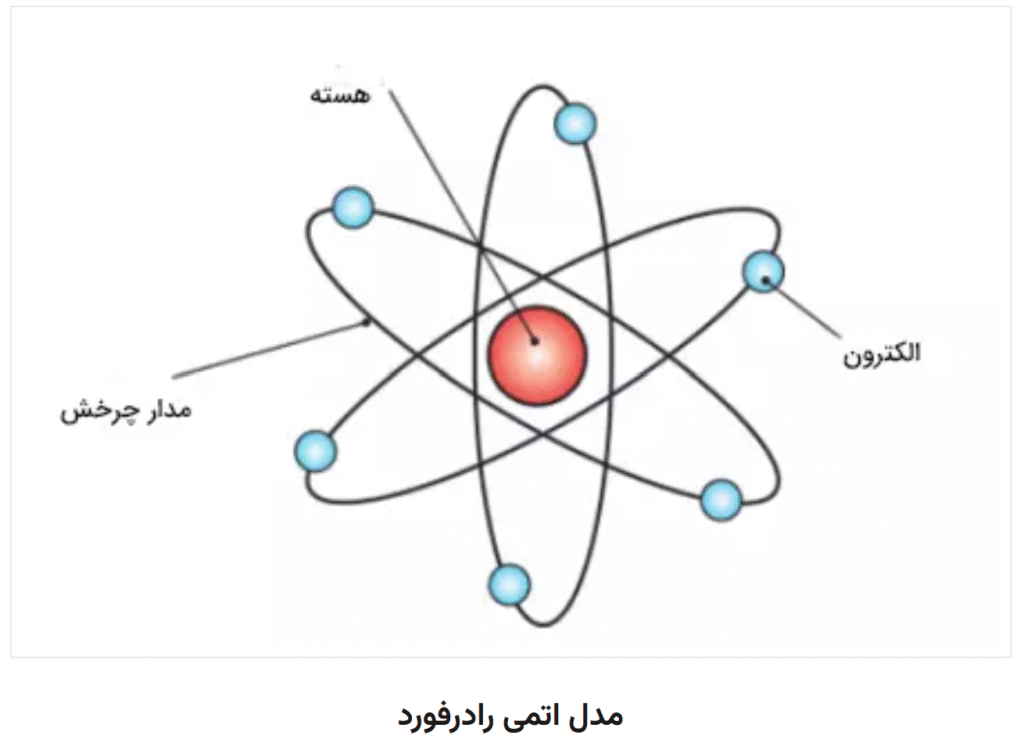
پیش از بور: مدل رادرفورد
رادرفورد با آزمایش معروف خود (پراکندگی ذرات آلفا) نشان داد که بیشتر حجم اتم خالی است و یک هستهی کوچک و پرجرم در مرکز اتم قرار دارد. الکترونها پیرامون این هسته در گردشاند.
اما مدل رادرفورد یک مشکل اساسی داشت: طبق قوانین فیزیک کلاسیک، الکترونهای در حال حرکت دایرهای باید انرژی از دست بدهند و در نهایت روی هسته سقوط کنند، که در عمل مشاهده نمیشد.
ورود نیلز بور و ایدههای کوانتومی
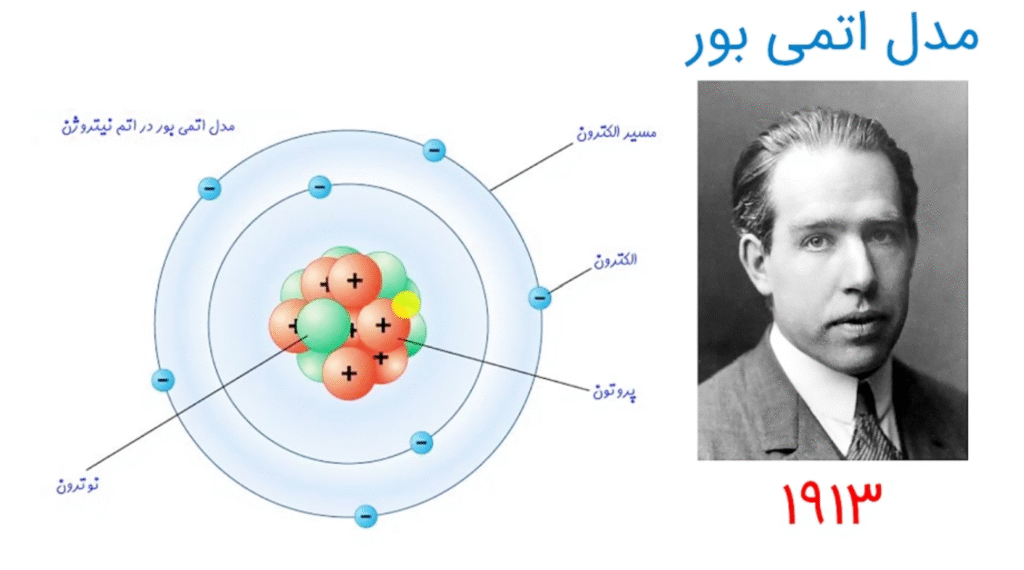
در سال ۱۹۱۳، نیلز بور با الهام از نظریه کوانتومی پلانک فرض کرد که:
الکترونها نمیتوانند در هر فاصلهای از هسته حرکت کنند.
تنها روی مدارهای مشخصی با انرژی معین میتوانند قرار بگیرند.
این ایده انقلابی نه تنها مشکل پایداری اتم را حل کرد، بلکه پایهای برای مدل طیفی اتمها شد.
اصول مدل اتمی بور
بور سه اصل اساسی برای مدل خود مطرح کرد:
مدارهای مشخص انرژی
الکترونها فقط مجاز به حرکت در مدارهایی با انرژی معین هستند. این مدارها با عدد کوانتومی اصلی …n=۱,۲,۳ مشخص میشوند.انتقال انرژی به صورت کوانتومی
هنگام انتقال الکترون از یک مدار به مدار دیگر، باید به اندازه اختلاف انرژی آنها، انرژی جذب یا آزاد شود. تغییر مدار فقط به صورت پلهای امکانپذیر است.عدم تابش در مدار پایدار
وقتی الکترون روی مدار مخصوص خود قرار دارد، انرژی از دست نمیدهد و بنابراین روی هسته سقوط نمیکند.
مدارها، تراز انرژی و طیف هیدروژن
مدار n=۱ نزدیکترین مدار به هسته است و کمترین انرژی را دارد، در حالی که مدارهای بالاتر انرژی بیشتری دارند. وقتی الکترون از مدار بالاتر به مدار پایینتر برود، انرژی آزاد شده به شکل فوتون ظاهر میشود.
این پدیده اساس شکلگیری طیف خطی هیدروژن است، جایی که نور هیدروژن از منشور عبور داده شود، فقط چند خط رنگی مشخص دیده میشود.
کاربردهای مدل بور
1. شیمی پایه و تدریس مدرسه
مدل بور برای دانشآموزان پایه دهم و پایه یازدهم اهمیت ویژهای دارد، زیرا فهم الکترونها و انرژی مدارها، پایه مفاهیم بعدی مانند پیوندهای شیمیایی و واکنشهاست.
2. پیوندهای یونی و ترکیبات شیمیایی
مدل بور کمک میکند بفهمیم چرا فلزات تمایل به از دست دادن الکترون دارند و نافلزات آن را جذب میکنند. این موضوع پایه محاسبات پیوند یونی و فرمول شیمیایی ترکیبات است.
3. الکتروشیمی
توزیع انرژی الکترونها و انتقال آنها در مدارهای مشخص، نقش کلیدی در واکنشهای الکتروشیمیایی و باتریها دارد.
موفقیتها و محدودیتهای مدل بور
مدل بور توانست طول موج خطوط طیف هیدروژن را پیشبینی کند و اولین توضیح کمی برای رفتار اتم ارائه دهد.
اما محدودیتهایی نیز دارد:
مدل برای اتمهای چندالکترونه دقیق نیست.
مکانیک کوانتومی مدرن تصویر دقیقتری از الکترونها ارائه میدهد، بهصورت ابرهای الکترونی.
با این حال، برای دانشآموزان و آموزشهای پایهای، مدل بور همچنان یک ابزار ساده و کاربردی است.
جمعبندی
مدل بور:
مشکل پایداری اتم رادرفورد را حل کرد.
توضیحی ساده و قابل فهم برای خطوط طیفی فراهم کرد.
پایهای برای درک پیوندهای یونی، الکتروشیمی، و شیمی پایه دبیرستان شد.
اگر میخواهید مفاهیم مدل بور را با مثالهای عملی و حل سوالات کنکوری عمیقتر یاد بگیرید، کلاسهای تدریس خصوصی شیمی به شما کمک میکنند تا درک مفهومی و مهارت حل مسئله را همزمان به دست آورید.