توضیح تئوری قانون هس
قانون هس که به “قانون جمع پذیری آنتالپی” نیز معروف است، یک اصل بنیادی در ترمودینامیک شیمیایی محسوب میشود. این قانون در سال ۱۸۴۰ توسط شیمیدان روسی-سوئیسی، گرمن هنری هس فرمولبندی شد.
قانون هس (Hess’s Law) که به ما کمک میکند تا تغییرات آنتالپی (ΔH) واکنشها را محاسبه کنیم. این قانون بهخصوص در مواردی که اندازهگیری مستقیم ΔH برای یک واکنش سخت یا غیرممکن است، بسیار مفید است.
قانون هس (Hess’s Law) یکی از بنیادیترین مفاهیم در ترمودینامیک شیمیایی است که به ما کمک میکند تا تغییرات انرژی در واکنشهای شیمیایی را محاسبه کنیم. این قانون بر پایه اصل حالت (State Function) بنا شده است و نشان میدهد که تغییرات آنتالپی (ΔH) یک واکنش مستقل از مسیر واکنش است و فقط به حالت اولیه و نهایی سیستم بستگی دارد.
طبق قانون هس:
“تغییر آنتالپی یک واکنش شیمیایی فقط به حالت اولیه و نهایی واکنش بستگی دارد و مستقل از مسیر واکنش است.”
این بدان معنی است که حتی اگر یک واکنش در چند مرحله انجام شود، مجموع تغییرات آنتالپی در تمام مراحل برابر با تغییر آنتالپی واکنش کلی خواهد بود.
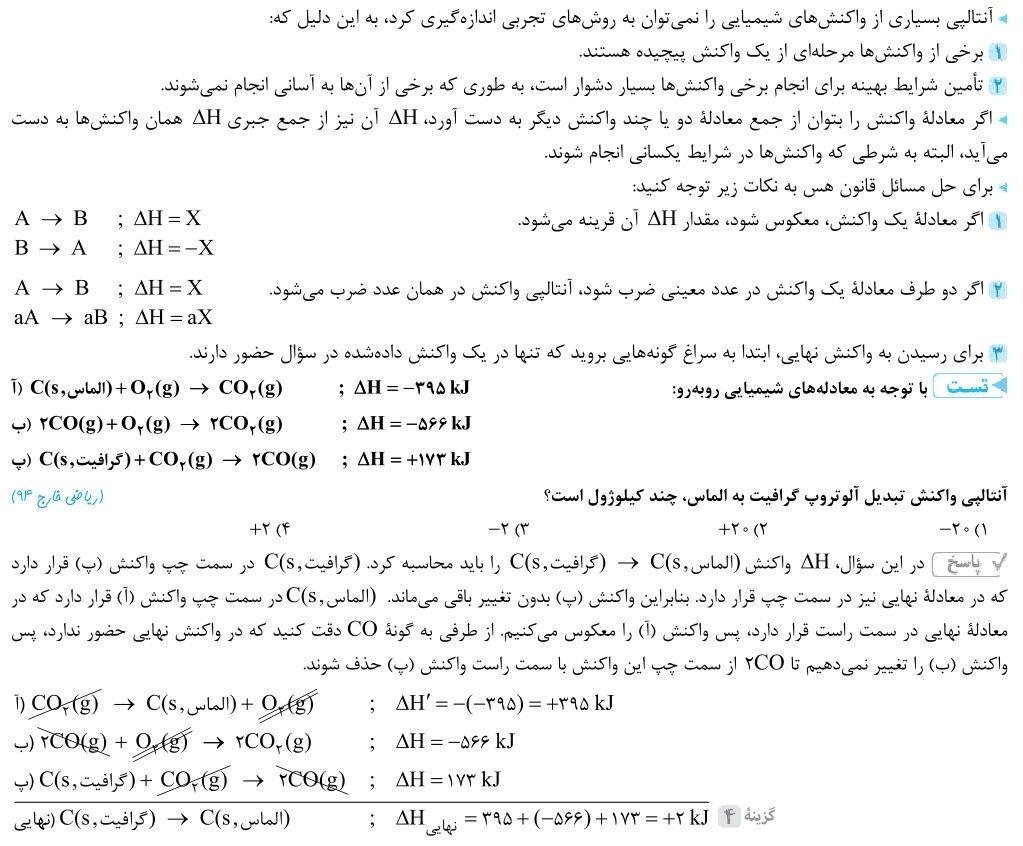
محاسبه آنتالپی پیوند در واکنشها با قانون هس امکانپذیر است
مراحل حل مسئله با قانون هس
برای حل مسائل مرتبط با قانون هس، مراحل زیر را دنبال کنید:
۱. معادلات دادهشده را بنویسید
- معادلات شیمیایی مربوط به مراحل مختلف واکنش را بهدقت بنویسید.
- اگر لازم است، معادلات را معکوس کنید (در این صورت علامت ΔH تغییر میکند).
۲. ضرایب معادلات را تنظیم کنید
- اگر ضرایب معادلات با معادله نهایی مطابقت ندارند، آنها را در یک عدد ضرب کنید.
- همزمان، مقدار ΔH را نیز در همان عدد ضرب کنید.
۳. معادلات را با هم جمع یا تفریق کنید
- معادلات را طوری ترکیب کنید که مواد اضافی (موادی که در معادله نهایی وجود ندارند) حذف شوند.
برای واکنشهای تعادلی، ترکیب قانون هس با محاسبات ثابت تعادل نتایج دقیقتری ارائه میدهد.
۴. مقادیر ΔH را جمعبندی کنید
- مقدار ΔH مربوط به هر مرحله را با توجه به علامت و ضرایب صحیح جمع کنید.